
服務熱線:021-60766769

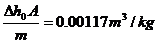
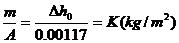
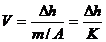 (m3/kg)
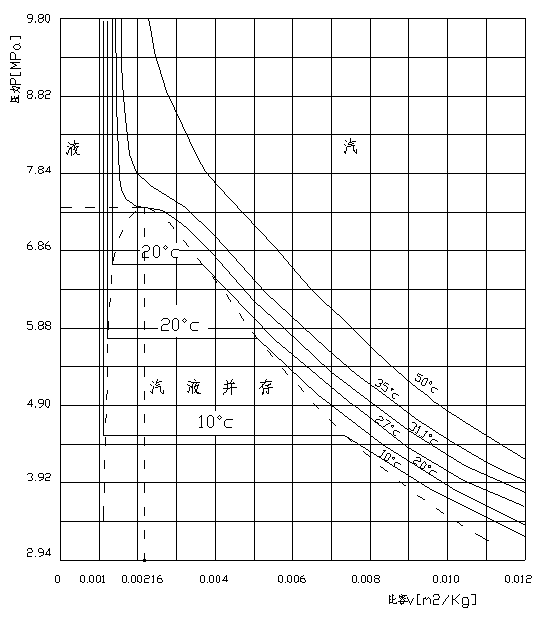
(m3/kg)| t=20℃ | t=31.1℃(臨界) | t=50℃ | |||||||||
|
p (Mpa) |
Δh | v=Δh/K | 現(xiàn)象 |
p (Mpa) |
Δh | v=Δh/K | 現(xiàn)象 |
p (Mpa) |
Δh | v=Δh/K | 現(xiàn)象 |
| 進行等溫線實驗所需時間 | |||||||||||
| 分鐘 | 分鐘 | 分鐘 | |||||||||
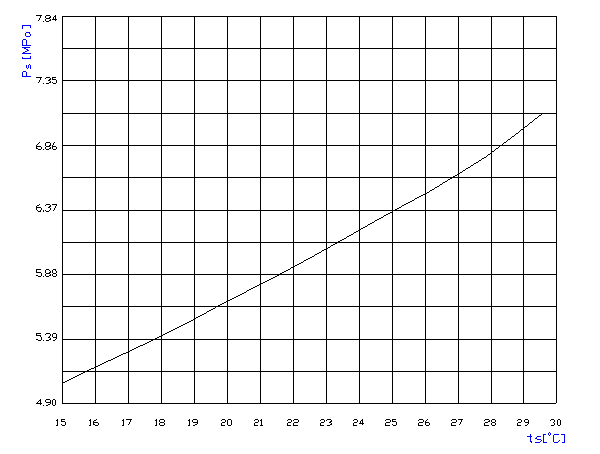
| 標準值 | 實驗值 | Vc=RTc/Pc | Vc=3/8 | RT/Pc |
| 0.00216 |
生產(chǎn)基地:上海松江工業(yè)園 銷售中心:上海市嘉定區(qū)鶴旋路26弄22號 電話:021-60766769 傳真:021-60766769 公司郵箱:yuykjsb@126.com 滬公網(wǎng)安備31010702001298號 教學設備|機械教學模型|樓宇實訓臺|維修電工實驗臺:上海育仰公司 All Rights Reserved ?滬ICP備16023097號-1 |